Portada » Química » El Impacto de las Proteínas en la Nutrición y la Tecnología Alimentaria
El Impacto de las Proteínas en la Nutrición y la Tecnología Alimentaria
Proteínas
Definición: moléculas grandes y complejas formadas por cadenas de aminoácidos que desempeñan funciones vitales en el cuerpo, como la estructura de tejidos, el crecimiento celular y la regulación de procesos metabólicos.
Importancia Nutricional
Importancia nutricional: fuente de aminoácidos esenciales, crecimiento y mantenimiento del organismo.
Propiedades Funcionales en Alimentos
- Modificación de textura: estabilidad y apariencia de los productos.
- Capacidad de gelificación: Gelatina, yogur, quesos.
- Capacidad espumante: Merengues, helados.
- Capacidad emulsionante: Mayonesa, embutidos.
- Capacidad de retención de agua: Carne, panificación, embutidos.
Aplicaciones Tecnológicas
Aplicaciones tecnológicas: Desarrollo de proteínas vegetales como sustitutos de carne, suplementos y fortificantes, recubrimientos comestibles, procesos de transformación, reacciones ante calor, pH, enzimas y presión, reacciones de Maillard, salud y seguridad alimentaria.
Aminoácidos
Clasificación de Aminoácidos
Alfa aminoácidos: Todos los aminoácidos en las proteínas son de este tipo. El grupo R varía en estructura, tamaño y carga eléctrica.
Aminoácido alifático: Construido por carbonos sin carga (alcanos).
Aminoácidos aromáticos no polares: Participan en interacciones hidrofóbicas. Absorben luz UV a 280 nm.
- No polares: Phe, Trp, Tyr.
Aminoácidos no polares alifáticos o hidrofóbicos: Alanina, valina, leucina, isoleucina. Tienden a estabilizar proteínas por interacciones hidrofóbicas. Reducen la flexibilidad estructural debido a su grupo amino.
Aminoácidos polares sin carga: Grupo hidrofílico, son solubles en agua, forman puentes de hidrógeno con el agua. Cistina por oxidación (forman puente disulfuro).
Aminoácidos con carga positiva: Tienen carga positiva a pH 7. Histidina: grupo imidazolio funciona como aceptor/donador de protones en centros reactivos de enzimas. Arginina: grupo guanidino interviene en el ciclo de la urea. Lisina: 2 grupos amino.
Aminoácidos con carga negativa: Tienen carga negativa a pH 7, tienen un segundo grupo carboxílico, Asp-Asn. Glu-Gln, una de sus funciones es transportar el grupo amino durante las reacciones de transaminación.
Propiedades Físicas de los Aminoácidos
Propiedades físicas de los aminoácidos: Sólidos, cristalizables, elevado punto de fusión 200°C, incoloros, algunos de sabor dulce, solubles en agua, actividad óptica, comportamiento anfótero.
Propiedad anfotérica: Disueltos en agua se presentan como iones dipolares, pueden actuar como ácido o base.
Formas enantioméricas: Por ser el carbono alfa un carbono asimétrico, los aminoácidos pueden presentar 2 configuraciones espaciales:
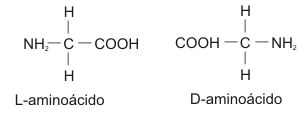
Al ser imágenes especulares se denominan estereoisómeros.
Actividad óptica: Carbono asimétrico: Desvía la luz polarizada que atraviesa una disolución de aminoácidos. Según hacia dónde desvía el plano de luz polarizada pueden ser:
- Dextrógiros: si desvía la luz hacia la derecha.
- Levógiros: si desvía la luz hacia la izquierda.
Punto isoeléctrico (pKI): Su carácter anfotérico les ofrece la capacidad de recibir y donar electrones y alcanzar un punto isoeléctrico cuando presentan el mismo número de carga positiva y negativa, por lo que su carga neta es 0. pKa=pK.
Constante de equilibrio de ionización: Mide la tendencia de un grupo a ceder protones, tiene punto isoeléctrico y carga neta a 0.
Aminoácidos Esenciales
Aminoácidos esenciales: Aquellos que el ser humano no puede sintetizar y deben obtenerse en la dieta. En alimentos son clave para valorar calidad proteica.
- Lisina: limitante en cereales, importante en balance de proteínas.
- Metionina: limitante en leguminosas, aporta azufre.
- Triptófano: precursor de serotonina, sensible al procesamiento.
- Valina, leucina, isoleucina: aminoácidos ramificados importantes en metabolismo energético.
- Fenilalanina, treonina, histidina: completan el grupo esencial.
Aminoácidos en Reacciones Químicas de Alimentos
Aminoácidos en reacciones químicas de alimentos:
- Lisina: muy reactivo en la reacción de Maillard (responsable del pardeamiento en pan, café, leche en polvo).
- Cisteína y metionina: azufrados participan en reacciones que generan aromas característicos (cebolla, ajo).
- Glutamina y asparagina: en tratamientos térmicos la asparagina puede formar acrilamida, un compuesto indeseable.
Aminoácidos Relacionados con Sabor
Aminoácidos relacionados con sabor:
- Ácido glutámico: base del umami (quesos maduros, tomate).
- Glicina y alanina: portan notas dulces en algunos alimentos.
- Leucina, isoleucina, valina: notas amargas en hidrolizados de proteína.
Aminoácidos con Función Tecnológica
Aminoácidos con función tecnológica:
- Prolina: estructura de colágeno y gelatina, fundamental en textura de carnes y geles.
- Lisina: usada en empaquetamiento de harinas y balance nutricional.
- Cisteína: se emplea como aditivo en panificación, mejora la masa.
Péptidos
Péptidos: Son moléculas con propiedades regeneradoras que surgen de la unión de diferentes aminoácidos a través de enlaces peptídicos.
Formación del enlace peptídico: Enlace covalente fuerte, condensación del grupo carboxilo de un aminoácido con el grupo amino de otro, con la pérdida de 1 molécula de agua (enlace amida).
Formación de péptidos: La cadena se irá alargando formando una cadena peptídica. Al inicio serán péptidos pequeños: dipéptido (2 aminoácidos), oligopéptido (30 aminoácidos), hasta llegar a formar cadenas largas y funcionales: polipéptido (PM10000).
Configuración cis o trans: Esta determinada por la limitación de giro del enlace C-N, configuración trans más estable, mayoría de las proteínas.
El comportamiento ácido-base y la carga neta de las proteínas va a estar determinado por el estado de los grupos amino y carboxilo terminales y por el de los grupos de las cadenas laterales ionizables.
Péptidos bioactivos (nutracéuticos y funcionales): Se liberan por digestión o hidrólisis enzimática de proteínas lácteas, cárnicas o vegetales.
Péptidos antihipertensivos inhibidores de la ECA: Presentes en caseína y suero de la leche.
Péptidos antioxidantes: Derivados de proteínas de soya, pescado, huevo, retardan oxidación en alimentos y protegen la salud.
Péptidos antimicrobianos: Como la lactoferricina (leche) o nizina (bacterias lácticas) usadas como conservadores naturales.
Péptidos inmunomoduladores: De leche materna, huevo y pescado que fortalecen defensas.
Péptidos hipocolesterolémicos: Presente en soya y avena, ayudan a reducir el colesterol LDL.
Péptidos antimicrobianos de aplicación industrial: Nisin producida por Lactococcus lactis: conservador natural aprobado por FAO y OMS, usado en quesos, carnes y enlatados.
Pediocina de Pediococcus acidilactici: controla Listeria monocytogenes en carnes procesadas.
Estructura de las Proteínas
Las proteínas son polímeros de aminoácidos.
En su composición intervienen 20 aminoácidos: Alanina, arginina, asparagina, ácido aspártico, cisteína, glutamina, ácido glutámico, glicina, histidina, isoleucina, leucina, lisina, metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina y valina.
Se forman en ribosomas celulares y después son transportados a donde sean requeridos. Todos tienen una estructura tridimensional que influye sobre su función. La estructura proteica es estabilizada por interacciones iónicas, hidrofóbicas, puentes de hidrógeno y disulfuro.
Estructura Primaria de las Proteínas
Estructura primaria de las proteínas: Secuencia de aminoácidos unidos covalentemente en la cadena proteica.
Estructura Secundaria de las Proteínas
Estructura secundaria de las proteínas: Es un arreglo local por interacciones de hidrógeno entre residuos de aminoácidos. Se consideran 2 tipos de arreglo: las hélices alfa y las hojas beta.
Hélice alfa: Es el arreglo más simple que puede asumir una cadena de polipéptido, hacen un giro cada 5.4°A (cada 3.6 aa), giro hacia la derecha.
Hoja beta: La cadena de aa se extiende en zigzag, las cadenas se arreglan lado a lado formando pliegues paralelos. Longitud de 5 a 10 aa, los puentes de hidrógeno se forman entre segmentos adyacentes de la cadena polipeptídica (C=O y -NH entre hebras).
Lámina beta intermolecular: (2 cadenas se acercan).
Lámina beta intramolecular: (una misma cadena).
Lámina Beta
Lámina beta: Los grupos R de los aminoácidos en la parte de contacto deben ser relativamente pequeños.
Queratina rica en Gly y Ala: Gly y Pro ocurren en las curvas B de proteínas globulares, las cadenas adyacentes pueden ser paralelas (misma orientación amino-carboxilo) o antiparalelas (carboxilo-amino).
Lámina beta paralela: Misma orientación de sus grupos amino y carboxilo terminales, periodo de repetición corto, los puentes de H están a distancias cortas pero forman un ángulo con la hebra (enlace más débil). Los extremos no forman puente de hidrógeno.
Lámina beta antiparalela: Disposición alternada, presentan zonas alternadas de puentes de H próximos y separados que se disponen perpendiculares al eje de la hebra. Los extremos no forman puente de hidrógeno.
Hélice de colágeno: Formada por 3 hélices alfa enrolladas de forma levógiros sobre sí mismas. Las 3 hélices alfa para formar la triple hélice de colágeno lo hacen de forma dextrógiros.
Composición de la hélice de colágeno: Composición de aa en las 3 cadenas Gly-x-y-Gly-x-y (cada 4 hay una glicina). X y Y son cualquier aa, se prefiere Pro, Hidroxiprolina, en menor proporción Lisina. Glicina es más pequeño y tiene capacidad de colocarse dentro de la hélice, los demás siempre hacia afuera.
Estructura Terciaria de las Proteínas
Estructura terciaria de las proteínas: Arreglo espacial de la cadena proteica, residuos de aminoácidos separados en la secuencia de péptidos de una proteína pueden interaccionar espacialmente gracias al plegamiento de la cadena peptídica. La localización, dirección y ángulo de las vueltas están determinadas por la localización de residuos de prolina, treonina, serina y glicina.
Plegamiento de las proteínas: Ocurre durante y después de la síntesis en los ribosomas, facilitado por las chaperonas.
Estructura Cuaternaria de las Proteínas
Estructura cuaternaria de las proteínas: Es el arreglo espacial entre subunidades de una misma proteína. 2 subunidades = dímero, 3 subunidades = trímero, 4 subunidades = tetrámero. Unidades iguales: homomultímeros, unidades diferentes: heteromultímeros.
Clasificación de las Proteínas
Holoproteínas o proteínas simples: Son proteínas formadas únicamente por aminoácidos, se dividen en globulares y fibrosas.
Heteroproteínas o proteínas conjugadas: Están formadas por una fracción proteica y por un grupo no proteico que se denomina grupo prostético. Se dividen en glucoproteínas, lipoproteínas, nucleoproteínas, cromoproteínas.
Función de las Proteínas en la Industria de Alimentos
Función de las proteínas en la industria de alimentos: Función nutricional, aportan aminoácidos esenciales para el crecimiento, mantenimiento y reparación de tejidos. Son fuente de energía (4 Kcal/g) y se utilizan para fortificación y suplementación (polvos proteicos, alimentos para atletas, fórmulas infantiles).
Función tecnológica o funcional: Capacidad de gelificación, emulsionante, espumante, de retención de agua, elasticidad y extensibilidad.
Gel o gelatina: Sistema coloidal en el que una fase líquida (generalmente agua) está atrapada dentro de una red tridimensional sólida, formada por moléculas como proteínas o polisacáridos. Consistencia semisólida, elástica y firme pero con alto contenido de agua.
Formación de un gel proteico: Disolución, desnaturalización y enfriamiento, formación de red tridimensional.
Sol: Fase líquida donde las moléculas como las proteínas gelificantes están dispersas pero no organizadas en una red sólida, tiene fluidez, es decir, que puede verterse como un líquido.
Proteínas gelificantes: Gelatina y colágeno hidrolizado.
Emulsión: Sistema coloidal donde un líquido (fase dispersa) está disperso en otro líquido (fase continua). Las gotas de la fase dispersa están suspendidas en la fase continua por reducción de la tensión superficial entre ambas fases.
Pasos de una emulsión alimentaria: Selección de fases, incorporación de energía, adición de emulsionantes y estabilización de la emulsión.
Espumas
Espumas: Dispersión de burbujas de gas en una matriz líquida o semisólida, estabilizada por agentes espumantes, comúnmente proteínas que forman una película alrededor de las burbujas para evitar que se rompan o se fusionen.
Formación de espumas: Incorporación de gas, adsorción de proteínas en la interfaz aire-líquido, desnaturalización y formación de red, estabilización de la espuma.
Función bioactiva y de conservación: Péptidos con actividad antimicrobiana = alargan vida útil. Péptidos antioxidantes: convierten a los alimentos en productos funcionales. Uso de recubrimientos comestibles: conservación natural de frutas y carnes.
Extensibilidad y Elasticidad de Proteínas
Extensibilidad: Capacidad para estirarse sin romperse, la proteína puede formar películas o redes flexibles.
Elasticidad: Capacidad para recuperar su forma original después de ser deformada, contribuye a la textura firme pero flexible de muchos alimentos.
Cómo actúan las proteínas en CRA: Hidratación, desnaturalización y formación de redes. Interacciones con otros componentes.
Relacionados
Publicidad
Temas
- Arte
- Biología
- Ciencias sociales
- Deporte y Educación Física
- Derecho
- Dibujo
- Diseño e Ingeniería
- Economía
- Educación Artística
- Educación Física
- Electrónica
- Español
- Filosofía
- Física
- Formación y Orientación Laboral
- Francés
- Geografía
- Geología
- Griego
- Historia
- Informática
- Inglés
- Latín
- Lengua y literatura
- Lenguas extranjeras
- Magisterio
- Matemáticas
- Medicina y Salud
- Música
- Otras materias
- Psicología y Sociología
- Química
- Relación en el Entorno de Trabajo
- Religión
- Tecnología
